Pembahasan soal Tes Kemampuan Dasar Sains dan Teknologi (TKD Saintek) Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN) tahun 2015 kode naskah 502 subtes Kimia nomor 36 sampai dengan nomor 40 tentang:
- energetika,
- reaksi reduksi dan oksidasi,
- elektrokimia,
- laju reaksi, serta
- kesetimbangan kimia.
Soal No. 36 tentang Energetika
Pentaboran-9 mudah terbakar menurut reaksi berikut:
2B5H9 (l) + 12O2 (g) → 5B2O3 (s) + 9H2O (l)
Bila entalpi pembentukan standar (ΔHfo) untuk 2B5H9 (l), B2O3 (s), dan H2O (l) berturut-turut adalah 73,2 kJ/mol, −1263,6 kJ/mol, dan −285,8 kJ/mol maka entalpi pembakaran standar (ΔHo) pentaboran-9 adalah ....
A. +9036,6 kJ/mol
B. −9036,6 kJ/mol
C. +4518,3 kJ/mol
D. −4518,3 kJ/mol
E. +1476,3 kJ/mol
Pembahasan
Karena yang ditanyakan entalpi pembakaran standar maka koefisien pentaboran-9 (B5H9) harus dijadikan 1 dulu.
B5H9 (l) + 6O2 (g) → 5/2 B2O3 (s) + 9/2 H2O (l)
Sehingga entalpi pembakaran standar reaksi tersebut adalah:
ΔHreaksi = ΔHhasil − ΔHpereaksi
= 5/2 × (−1263,6) + 9/2 × (−285,8) − 73,2
= −3159 − 1286,1 − 73,2
= −4518,3
Jadi, entalpi pembakaran standar pentaboran-9 adalah −4518,3 kJ/mol (D).
Soal No. 37 tentang Reaksi Reduksi dan Oksidasi
Reaksi yang menunjukkan zink sebagai reduktor adalah ....
- Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
- Zn + H2SO4 → ZnSO4 + H2
- Zn + 4HNO3 → Zn(NO3)2 + 2H2O + 2NO2
- Zn + 2HCl → ZnCl2 + H2

Pembahasan
Bilangan oksidasi Zn dalam unsur adalah nol sedangkan bilangan oksidasi Zn dalam senyawa selalu positif karena Zn adalah logam (biloks logam selalu positif).
Dari keterangan di atas, tampak jelas bahwa biloks Zn di ruas kiri adalah nol dan biloks Zn di ruas kanan adalah positif sehingga Zn mengalami kenaikan bilangan oksidasi. Dengan demikian, semua Zn pada reaksi di atas mengalami oksidasi atau bertindak sebagai reduktor.
Jadi, reaksi yang menunjukkan Zn sebagai reduktor adalah reaksi nomor 1, 2, 3, dan 4 (E).
Soal No. 38 tentang Elektrokimia
Suatu baterai dengan elektroda Cu2+ | Cu dan Cd2+ | Cd pada keadaan standar menghasilkan arus 0,8 A selama 200 menit.
Nilai Eo Cu2+ | Cu = +0,34 V, Eo Cd2+ | Cd = −0,40 V, F = 96500 C/mol elektron, Ar Cu = 63,5, dan Ar Cd = 112.
Pengurangan massa di anoda adalah ....
A. 0,6 g
B. 3,2 g
C. 5,6 g
D. 6,3 g
E. 11,2 g
Pembahasan
Pada sel elektrolisis, anoda adalah elektroda positif sedangkan pada sel elektrokimia (baterai, aki), anoda adalah elektroda negatif. Karena potensial Cu = +0,34 V dan potensial Cd = −0,40 V maka yang bertindak sebagai anoda adalah Cd.
Di anoda, Cd mengalami oksidasi sesuai reaksi:
Cd → Cd2+ + 2e
Reaksi oksidasi tersebut menyebabkan Cu Cd mengalami pengurangan massa. Besar pengurangan massanya adalah: (t = 200 menit = 12.000 detik)
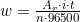
=3,25,6
Jadi, pengurangan massa di anoda adalah
Soal No. 39 tentang Laju Reaksi
Reaksi fasa gas:
2NO (g) + Br2 (g) → 2NOBr (g)
dilakukan dalam wadah tertutup dengan konsentrasi awal reaktan yang berbeda-beda. Pada tabel di bawah ini, yang dimaksud dengan waktu reaksi (t) adalah waktu dari awal reaksi sampai hilangnya warna Br2.
| Percobaan | [NO]o (M) | [Br2]o (M) | t (menit) |
| 1 2 3 | 0,10 0,10 0,20 | 0,05 0,10 0,05 | 4 2 1 |
Berdasarkan data ini, persamaan laju reaksi tersebut adalah ....
A. r = k [NO]2
B. r = k [Br2]
C. r = k [NO] [Br2]
D. r = k [NO] [Br2]2
E. r = k [NO]2 [Br2]
Pembahasan
Langkah pertama adalah menentukan orde reaksi.
Orde reaksi NO (berdasarkan [Br2] yang tetap, yaitu percobaan 1 dan 3).
2m = 4
m = 2
Orde Br2 (berdasarkan [NO] yang tetap, yaitu percobaan 1 dan 2).
Dengan demikian, persamaan laju reaksinya adalah:
r = k [NO]m [Br2]n
r = k [NO]2 [Br2]
Jadi, persamaan laju reaksi tersebut adalah opsi (E).
Soal No. 40 tentang Kesetimbangan Kimia
Pada kondisi tekanan dan temperatur tertentu dalam wadah tertutup 10 L, diperoleh sistem kesetimbangan berikut:
2HBr (g) ⇌ H2 (g) + Br2 (g)
Konsentrasi semua zat dalam kesetimbangan masing-masing adalah 0,3 M. Bila ke dalam sistem ditambahkan gas H2 dan gas Br2 masing-masing sebanyak 3 mol maka konsentrasi HBr pada kesetimbangan yang baru adalah ....
A. 0,1 M
B. 0,4 M
C. 0,5 M
D. 0,6 M
E. 0,7 M
Pembahasan
Kita tentukan dulu konstanta kesetimbangan awalnya.
= 1
Kemudian ke dalam sistem ditambahkan gas H2 dan gas Br2 masing-masing sebanyak 3 mol sehingga diperoleh:
mol HBr = 0,3 M × 10 L = 3 mol
mol H2 = 3 mol + 3 mol = 6 mol
mol Br2 = 3 mol + 3 mol = 6 mol
Karena penambahan konsentrasi terjadi di ruas kanan maka reaksi akan bergeser ke ruas kiri untuk mencapai kesetimbangan baru. Sehingga pada keadaan setimbang, mol ruas kiri merupakan hasil jumlah keadaan awal dan keadaan reaksi sedangkan mol ruas kanan merupakan pengurangan keadaan awal dan keadaan reaksi.
| 2HBr | ⇌ | H2 | + | Br2 | |
| awal | 3 | 6 | 6 | ||
| reaksi | 2x | x | x | ||
| setimbang | 3+2x | 6−x | 6−x |
Nilai konstanta kesetimbangan baru akan selalu sama dengan nilai konstanta kesetimbangan awal (konstanta kesetimbangan hanya berubah saat terjadi pergeseran kesetimbangan).
(3 + 2x)2 = (6 − x)2
3 + 2x = 6 − x
3x = 3
x = 1
Dengan demikian, konsentrasi HBr pada kesetimbangan baru adalah:
3 + 2x = (3 + 2×1) mol
= 5 mol
[HBr] = 5 mol / 10 L
= 0,5 M
Jadi, konsentrasi HBr pada kesetimbangan yang baru adalah 0,5 M (C).
Simak Pembahasan Soal TKD Saintek SBMPTN 2015 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.





