Pembahasan soal Kimia UN 2015 nomor 31 sampai dengan nomor 35 tentang:
- pergeseran kesetimbangan,
- hukum II Faraday,
- sel elektrolisis,
- reaksi reduksi dan oksidasi, serta
- korosi.
Soal No. 31 tentang Pergeseran Kesetimbangan
Diketahui reaksi kesetimbangan:
N2(g) + 2O2(g) ⇌ 2NO2(g), ΔH = +180 kJ
Jika volume tetap dan suhu dinaikkan maka kesetimbangan akan bergeser ke ....
A. kanan, karena bergeser ke reaksi endoterm
B. kanan, karena bergeser ke reaksi eksoterm
C. kiri, karena bergeser ke reaksi endoterm
D. kiri, karena bergeser ke reaksi eksoterm
E. kesetimbangan tidak bergeser
Pembahasan
Jenis reaksi di atas adalah reaksi endoterm yang ditandai dengan nilai ΔH yang positif. Artinya, reaksi ke kanan adalah reaksi endoterm sebaliknya reaksi ke kiri adalah reaksi eksoterm.

Jika suhu diperbesar maka reaksi akan bergeser ke endoterm atau ke kanan.
Jadi, pada volume tetap dan suhu dinaikkan, kesetimbangan akan bergeser ke kanan, karena bergeser ke arah endoterm (A).
Perdalam materi ini di Pembahasan Kimia UN: Kesetimbangan Kimia.
Soal No. 32 tentang Hukum II Faraday
Ke dalam 2 sel, larutan Ni(NO3)2 dan larutan AgNO3 yang disusun secara seri dialirkan arus listrik, ternyata diendapkan 14,75 gram nikel. Jika Ar Ag = 108 dan Ar Ni = 59 maka banyaknya logam Ag yang mengendap adalah ....
A. 2,70 gram
B. 5,40 gram
C. 13,50 gram
D. 27,00 gram
E. 54,00 gram

Penyelesaian
Ini adalah soal elektrolisis yang berhubungan hukum II Faraday. Cirinya, dalam soal terdapat kata kunci 'rangkaian seri', 'arus sama', dan sejenisnya. Selain itu, hukum II Faraday juga untuk menyelesaikan soal elektrolisis yang diketahui data-data pada anoda tetapi ditanyakan data-data pada katoda.
Perumusan hukum II Faraday
mol1 . n1 = mol2 . n2
Misalkan indeks (1) mewakili Ni dan indeks (2) mewakili Ag, diperoleh:

Sedangkan n adalah valensi. Valensi dapat diperoleh dengan mengionkan masing-masing larutan.
Ni(NO3)2 → Ni2+ + 2 NO3− n1 = 2
AgNO3 → Ag+ + NO3− n2 = 1
Sekarang tinggal memasukkan data-data tersebut pada rumus Faraday
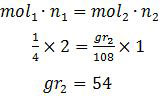
Jadi, logam Ag yang mengendap adalah 54 gram (E).
Soal No. 33 tentang Sel Elektrolisis
Perhatikan sel elektrolisis berikut!

Reaksi yang terjadi di katoda adalah ....
A. Cr(s) → Cr3+(aq) + 3e
B. K+(aq) + e → K(s)
C. Cr3+(aq) + 3e → Cr(s)
D. NO3−(aq) + 4H+(aq) + 3e → NO(g) + 2H2O(l)
E. 2H2O(l) + 2e → H2(g) + 2OH−(aq)
Jawab
Gambar di atas adalah elektrolisis
katoda : K+ + e → K
anoda : Cr → Cr3+ + 3e
Jadi, reaksi yang terjadi di katoda adalah reduksi logam K (B).
Perdalam materi ini di Pembahasan Kimia UN: Sel Elektrolisis dan Hukum Faraday.
Soal No. 34 tentang Reaksi Reduksi dan Oksidasi
Diketahui persamaan reaksi:
2Na2S2O3 + 4HCl → 2S + 2SO2 + 2H2O + 4NaCl
Zat yang mengalami autoredoks beserta perubahan bilangan oksidasinya adalah ....
A. S dari +2 ke 0 dan +4
B. S dari −2 ke 0 dan +4
C. S dari +4 ke 0 dan +4
D. S dari −4 ke 0 dan +2
E. S dari −2 ke 0 dan +2
Pembahasan
Autoredoks adalah reaksi reduksi dan oksidasi yang terjadi pada satu unsur. Jadi, unsur tersebut bertindak sebagai oksidator sekaligus reduktor. Autoredoks juga dikenal dengan istilah disproporsionasi.
Mari kita tentukan biloks masing-masing unsur tanpa melibatkan koefisien. Sebelumnya, coba perhatikan opsi jawaban. Secara implisit, semua opsi jawaban menyatakan bahwa S mengalami autoredoks.
Sekarang kita hanya fokus memperhatikan biloks S di ruas kiri dan kanan. Unsur yang tidak mengandung S tidak perlu ditulis, supaya soal terkesan mudah dan sederhana.

Jadi, zat mengalami autoredoks beserta perubahan bilangan oksidasinya adalah S dari
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia.
Soal No. 35 tentang Korosi
Perhatikan gambar percobaan berikut!
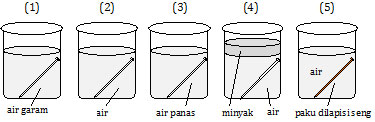
Paku yang mengalami perkaratan yang paling cepat adalah nomor ....
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Penyelesaian
Faktor yang memengaruhi korosi atau perkaratan pada besi:
- besi berada pada medium yang mengandung O2 dan H2O (medium yang lembab),
- pH larutan,
- garam-garam, dan
- kontak besi dengan logam lain.
Gambar (1) memenuhi point 1 dan 3, yaitu paku berada pada medium yang mengandung O2 (tabung terbuka) dan H2O (terendam dalam air), serta berada dalam larutan garam.
Pada gambar 5, sebenarnya seng lebih mudah teroksidasi, tetapi senyawa oksida yang dihasilkan bersifat inhibitor yang akan menutup rapat logam yang dilingkupinya.
Jadi, paku yang mengalami perkaratan yang paling cepat adalah nomor 1 (A).
Perdalam materi ini di Pembahasan Kimia UN: Korosi.
Simak Pembahasan Soal Kimia UN 2015 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.





