
Pembahasan soal-soal Ujian Nasional SMA IPA bidang studi Kimia dengan materi pembahasan Sistem Periodik Unsur.
Soal Sistem Periodik Unsur UN 2011
Letak unsur X dengan nomor atom 26 dan nomor massa 56 dalam sistem periodik pada golongan dan periode ….
A. II A dan 6
B. VI B dan 3
C. VI B dan 4
D. VIII B dan 3
E. VIII B dan 4
Pembahasan
Untuk menentukan golongan dan periode, kita harus memahami istilah elektron valensi. Elektron valensi adalah elektron terluar. Elektron terluar ini bisa menempati satu atau dua subkulit.
| Golongan | Valensi |
| Utama (A) | ns ns np |
| Transisi (B) | ns (n − 1)d |
| Lantanida | 6s 4f |
| Aktinida | 7s 5f |
Perhatikan konfigurasi elektron unsur X berikut.
26X : [Ar] 4s2 3d6
Elektron terluar unsur X adalah 2 dan 6 terletak pada valensi 4s 3d. Berarti unsur X merupakan unsur transisi golongan VIII (2 + 6) atau golongan VIII B.
Sedangkan untuk menentukan periode cukup dengan memperhatikan harga n, sehingga unsur X adalah 4.
Jadi, unsur X terletak pada golongan VIII B periode 4 (E).
Soal Sistem Periodik Unsur UN 2009
Unsur
A. IV A, 3
B. V A, 2
C. VI A, 3
D. VII A, 3
E. IV B, 2

Pembahasan
Konfigurasi elektron unsur T adalah
16T : [Ne] 3s2 3p4
- valensi : 3s 3p (A)
- jumlah elektron valensi : 2 + 4 = 6
- periode : 3
Jadi, unsur T terletak pada golongan VI A periode 3 (C).
Soal Sistem Periodik Unsur UN 2014
Notasi unsur M dilambangkan sebagai berikut:
Konfigurasi elektron dan letak unsur M pada tabel periodik modern secara berturut-turut adalah ….
| Konfigurasi Elektron | Golongan | Periode | |
| A. | [Ar] 4s2 4p6 | IV A | 4 |
| B. | [Ar] 4s2 3d2 | IV B | 4 |
| C. | [Ar] 4s2 4d2 | IV B | 5 |
| D. | [Kr] 5s2 5p2 | IV A | 5 |
| E. | [Kr] 5s2 4d10 | II B | 5 |
Pembahasan
Konfigurasi elektron unsur M adalah
22M : [Ar] 4s2 3d2
- valensi : 4s 3d (B)
- jumlah elektron valensi : 2 + 2 = 4
- periode : 4
Jadi, unsur M mempunyai konfigurasi elektron [Ar] 4s2 3d2 dan terletak pada golongan IV B periode 4 (B).
Soal Sistem Periodik Unsur UN 2013
Letak unsur dan konfigurasi elektron yang tepat untuk unsur
| Golongan | Periode | Konfigurasi Elektron | |
| A. | I A | 4 | [Ar] 4s1 |
| B. | I B | 1 | [Ar] 4d1 |
| C. | II A | 1 | [Ar] 4s2 |
| D. | II B | 2 | [Ar] 4d2 |
| E. | V A | 3 | [Ar] 4s2 3d2 |
Pembahasan
Konfigurasi elektron unsur X adalah
19X : [Ar] 4s1
- valensi : 4s (A)
- jumlah elektron valensi : 1
- periode : 4
Jadi, unsur X terletak pada golongan I A periode 4 (A).
Soal Sistem Periodik Unsur UN 2015
Berikut tabel data unsur dan nomor atomnya.
| Unsur | Nomor Atom |
| K | 9 |
| L | 17 |
| M | 35 |
| N | 53 |
Grafik yang menunjukkan kecenderungan keelektronegatifan dari unsur-unsur tersebut adalah ….
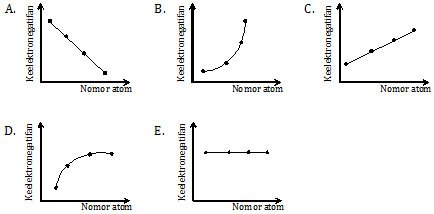
Pembahasan
Jika diingat nomor atom gas mulia
2, 10, 18, 36, 54, 86
maka nomor atom yang disebutkan dalam soal adalah nomor atom gas mulia dikurangi 1, yaitu golongan VII A (halogen), tetangganya gas mulia. Dengan kata lain, unsur-unsur tersebut terletak dalam satu golongan.

Dalam satu golongan, keelektronegatifan unsur dari atas ke bawah makin kecil. Berarti sifat keelektronegatifannya makin berkurang.
Bila dibuatkan grafiknya akan menunjukkan grafik yang cenderung turun. Pada opsi jawaban, hanya opsi A yang menunjukkan grafik turun. Sedangkan opsi B, C, dan C cenderung naik, dan opsi E konstan.
Jadi, grafik kecenderungan keelektronegatifan dari unsur-unsur tersebut adalah opsi (A).
Pembahasan soal Sistem Periodik Unsur yang lain bisa disimak di:
Pembahasan Kimia UN 2014 No. 2
Pembahasan Kimia UN 2016 No. 2
Pembahasan Kimia UN 2017 No. 4
Pembahasan Kimia UN 2019 No. 2 dan 3
Pembahasan Kimia UN 2019 No. 14
Simak juga, Pembahasan Kimia UN Jenis Ikatan Kimia.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

